Harnblasenkarzinom
In Anlehnung an die Verfahrensanleitungen (ausführliche Darstellung, die weniger für Patienten und Angehörige geeignet sind).
Diagnostik Jede Blutbeimengung im Urin, sichtbar (Makrohämaturie) oder unsichtbar (Mikrohämaturie) sollte an ein Harnblasenkarzinom denken lassen; außerdem können Schmerzen beim oder häufiges Wasserlassen auf einen Harnblasentumor hindeuten. Vor allem bei persistierender Symptomatik und fehlendem Infektnachweis muss ein Blasentumor und ein sog. Carcinoma in situ ausgeschlossen werden. Wir empfehlen folgende Untersuchungen:
  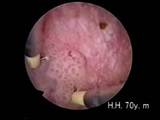 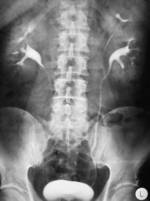
Eine alleinige Urinzytologie ist zum Ausschluß eines Tumors ungeeignet und ersetzt nicht die Zystoskopie. Eine positive Zytologie weist auf einen aggressiven Tumor hin. Andere Markersysteme, wie NMP22 oder BTA Test empfehlen wir nicht.
Transurethrale Elektroresektion (TUR)
Nicht invasives Harnblasenkarzinom (Ta, Tis) Nicht invasive Blasenkarzinome werden nach Prognosefaktoren in 3 Risikogruppen eingeteilt (EAU Leitlinien):
Bei Patienten mit nicht invasiven Tumoren (ausser T1G3), ist eine weitere Diagnostik nicht nötig, da keine Metastasen zu befürchten sind. Bei fortgeschrittenen Tumoren ist die Suche nach Lymphknoten und Fernmetastasen obligat.
Die Treffsicherheit von CT, MRT und PET-CT in der Erkennung von Lymphknotenmetastasen im kleinen Becken beträgt nur 80%. Daher sollten, wenn eine offene Tumoroperation geplant ist, die Lymphknoten im kleinen Becken operativ entfernt und histologisch untersucht werden. Patienten mit invasiven Karzinomen, bei denen eine Entfernung der Harnblase geplant ist, werden derzeit in unserer Klinik studiengestützt im Rahmen des LEA Protokolls operiert. Hierbei wird entweder das Standardfeld der Beckenlymphknoten oder alternativ ein vergrößertes Areal entfernt.
Der Ausschluß von Lungenmetastasen erfolgt durch die Röntgenuntersucheung der Thoraxorgane in zwei Ebenen. In Einzelfällen ohne Nachweis anderer Metastasen kann die CT angezeigt sein. Eine Skelettszintigraphie ist bei Patienten mit Knochenschmerzen angezeigt. Die Abklärung von Lebermetastasen erfolgt mittels Sonographie.
Besteht bei geplanter kontinenter Harnableitung der Verdacht auf Darmerkrankungen, kann eine CT des Abdomens und/oder eine Coloskopie bzw. virtuelle Koloskopie in Form einer MRT durchgeführt werden.
Einteilung des Harnblasenkarzinoms (UICC 2002)
Differenzierungsgrad papillärer Urotheltumoren
Therapie des Harnblasenkarzinoms
Empfehlungen zur operativen Therapie des nicht invasiven , oberflächlichen Karzinoms (Ta-T1, TIS)
Transurethrale Elektroresektion (TUR) Die TUR ist beim oberflächlichen Harnblasenkarzinom ein Eingriff mit diagnostischer und kurativer Zielsetzung: Es wird Gewebe für die pathologisch-histologische Beurteilung gewonnen und eine vollständige Entfernung des Tumorgewebes angestrebt. Die photodynamische Therapie (PDT) ist als experimentell anzusehen.
Adjuvante Instillationstherapie Zur intravesikalen Rezidivprophylaxe stehen Zytostatika (Doxorubicin, Mitomycin C) und der Immunmodulator BCG (Bacillus Calmette-Guérin) zur Verfügung. Die intravesikale Therapie erzielt keinen Effekt auf die Progression der Erkrankung. Die Rezidivrate kann nach einer Metaanalyse signifikant um 6-15% gesenkt werden Ein Chemotherapeutikum der ersten Wahl zur Rezidivprophylaxe oberflächlicher Blasenkarzinome läßt sich aus den vorhandenen Daten nicht ableiten. Während bei Patienten mit niedrigem Progressionsrisiko die Chemo- und Immuntherapie als gleichwertig anzusehen ist wird bei hohem Progressionsrisiko (G3-Tumoren, Rezidivtumoren) die intravesikale Behandlung mit BCG vorgezogen.
Die Therapieschemata für die intravesikale Chemo- und Immunprophylaxe sind nicht standardisiert. Gemeinsamer Nenner sind eine „Induktionsphase“ über 6 bis 8 Wochen und eine „Erhaltungsphase“ im Sinne einer Langzeittherapie.
Für die Chemoprophylaxe ist ein früher Beginn unmittelbar nach TUR vorteilhaft und ohne Gefahr möglich. Nach einer Metaanalyse reduziert eine Frühinstillation bei Tumoren mit niedrigem Progressionsrisiko das Rezidivrisiko um 11% gegenüber einer alleinigen TUR-B.
Der Therapiebeginn mit BCG sollte frühestens zwei Wochen nach TUR erfolgen, um systemische Nebenwirkungen zu vermeiden. Im Rahmen einer Metaanalyse zeigte der Einsatz von BCG eine Reduktion der Tumorprogression um lediglich 4%, ohne Einfluß auf das überleben der Patienten. Dieser Effekt war nur mit einer BCG-Erhaltungstherapie über 36 Monate zu erzielen.
Patienten mit pT1G3-Tumoren sind eine besondere Risikogruppe, da der Tumor häufig progredient wird. Nach vollständiger TUR ist der Versuch der organerhaltenden Therapie mittels intravesikaler BCG-Instillationsprophylaxe erlaubt. Bei dem Rezidiv des pT1G3-Tumors innerhalb von 3 bis 6 Monaten ist die Zystektomie indiziert, da das Progressionsrisiko in diesem Fall hoch ist.
Einen Sonderfall stellt das Carcinoma in situ (Tis) dar: Das Rezidiv- und Progressionsrisiko ist hoch und beträgt nach alleiniger TUR bis zu 30%. Die intravesikale Therapie mit BCG nach der TUR ist als Teil der Primärbehandlung anzusehen. Bei etwa 70% der Patienten wird damit eine Vollremission über die Dauer von fünf Jahren erreicht. Versagt diese Therapie, ist die radikale Zystektomie sinnvoll.
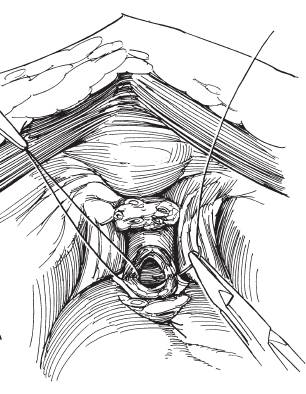
Radikale Zystektomie Pelvine Lymphadenektomie: Die pelvine Lymphadenektomie ist Bestandteil der radikalen Zystektomie. Die Zielsetzung ist primär diagnostisch und es gibt zunehmend Hinweise auch auf einen therapeutischen Wert. Die Lymphknotendissektion erstreckt sich auf die Lymphknoten in der Fossa obturatoria und der Vasa iliaca externa bis zum Abgang der A. iliaca interna. Fakultativ kann der Eingriff bis in Höhe der Aortenbifurkation ausgedehnt werden.
Operatives Vorgehen beim Mann:
Operatives Vorgehen bei der Frau: Entfernt werden Blase und aus Gründen der Radikalität ist das bisher akzeptierte Verfahren die Entfernung von Uterus, beide Adnexen (bei jüngeren Patienten wird 1 Adnexe belassen), Vaginaldach und Urethra. In Abhängigkeit von der Tumorlokalisation und der Tumorausdehnung kann auf die Entfernung von Uterus, Adnexen und Vaginaldach verzichtet werden. Bei Anlage einer Neoblase bei der Frau werden die Urethra mit dem Sphinkter sowie das Vaginaldach erhalten. Dabei sollte der urethale Absetzungsrand in der intraoperativen Schnellschnittdiagnostik tumorfrei sein, und präoperativ kein Tumor im Bereich des Blasenhalses und der Urethra.
Harnableitung
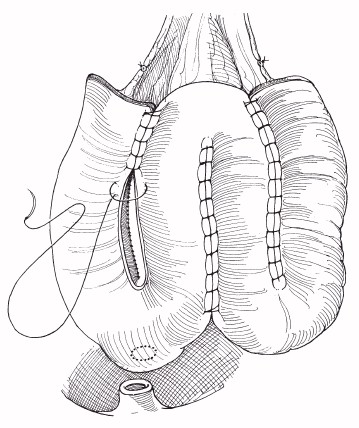
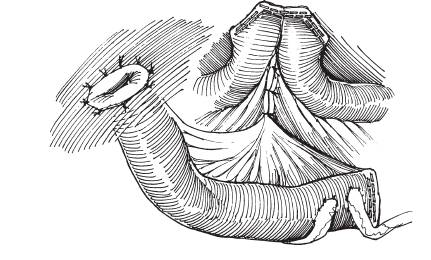
Inkontinente Harnableitung: Die einfachste Form der Harnableitung ist das Ureterhautstoma. Nachteil ist die hohe Inzidenz an Engen im Hautniveau und die dauerhafte Versorgung des Stomas mit einem DJ-Katheter. Die Indikation zur Ureterokutaneostomie ist auf Risikopatienten beschränkt, denen eine Darmoperation nicht mehr zugemutet werden kann (Koontz et al. 1986). Bei einer Harnableitung über ein intestinales Conduit ist die Stenosegefahr gering. Als Darmanteile eignen sich Ileum (Abb. 1), Colon sigmoideum oder Colon transversum. Ausschlaggebend für die Wahl ist die Darmbeschaffenheit nach evtl. Vorbestrahlung.
Ileum Conduit: Beim orthotopen Blasenersatz (Neoblase) wird das Darmreservoir aus Ileum oder Colon an die Harnröhre anastomosiert. Die Miktion erfolgt durch Bauchpresse, die Kontinenz ist durch den eigenen äußeren Schließmuskel gewährleistet (Abb. 2). Ist die Harnröhre nicht zu nutzen, z.B. weil sie wegen Tumorbefall entfernt wurde, kann das Darmreservoir über ein kontinentes Stoma an die Bauchdecke angeschlossen werden (Pouch). Die Entleerung erfolgt durch Einmalkatheterismus. Eine weitere Möglichkeit der kontinenten Harnableitung ist die Harnleiterdarmimplantation (Ureterosigmoideostomie). Kontinenzmechanismus ist in diesem Fall der anale Schließmuskel. Die Vielzahl der Harnableitungsformen ermöglicht es, die individuellen Bedürfnisse des Patienten zu berücksichtigen.
Ileum Neoblase:
Systemische Chemotherapie bei Patienten mit Lymphknoten- oder Fernmetastasen Cisplatin, Methotrexat, Gemcitabin und Taxane erreichen als wirksame Einzelsubstanzen Gesamtremissionsraten von ca. 30%. Kombinationen methotrexat- und cisplatinhaltiger Schemata weisen eine Remissionsrate von 56-65% auf. In einer prospektiv randomisierten Studie zeigte das MVAC-Protokoll im Vergleich zu einer Kombination aus Gemcitabine und Cisplatin keinen Unterschied hinsichtlich des Gesamtüberlebens; der Gemcitabine-Cisplatin-Arm hatte ein reduziertes Toxizitätsprofil. Bei manifester Metastasierung ist die Polychemotherapie die akzeptierte Behandlungsform mit initial 2 Zyklen. Eine Fortführung der Therapie ist bei objektivem und subjektivem Ansprechen angezeigt, andernfalls sollte eine Umstellung der Therapie erfolgen. Bei ca. 10-30% der Patienten mit metastasierter Erkrankung kann eine komplette Remission erzielt werden, die bei ca. 13% länger anhaltend ist. Die durch Chemotherapie verursachte Knochenmarkdepression limitiert häufig die zeitgerechte Behandlung mit erhaltener Dosisintensität. Durch eine begleitende Applikation von Granulocyte Colony-Stimulating Factor (G-CSF) ist es möglich, das Auftreten, die Dauer und die Schwere von Grad-3-Leukopenien nach WHO zu reduzieren.
Besondere Situationen
Urothelkarzinom im Nierenbecken und Harnleiter Das Urothelkarzinom im oberen Harntrakt tritt bei etwa 5% der Patienten mit Blasenkarzinom auf, während die Patienten mit einem Urothelkarzinom im oberen Harntrakt weitere Tumoren in der Blase in etwa 50-75% der Fälle aufweisen. Die Abklärung erfolgt durch retrograde Ureteropyelographie, Zytologie und Ureterorenoskopie ggf. mit Biopsie. Bei monofokalen Tumoren im distalen Harnleiterdrittel ist die Ureterteilresektion mit Ureterblasenneueinpflanzung angezeigt. Bei höhergelegenen oder multifokalen Tumoren ist die Therapie der Wahl bei intakter kontralateraler Nierenfunktion die Nephroureterektomie mit Entnahme einer Blasenmanschette.In Ausnahmefällen kann die endoskopische organerhaltende Therapie mittels perkutaner oder ureteroskopischer Elektroresektion und/oder Laserkoagulation durchgeführt werden.
Adenokarzinom Adenokarzinome machen nur 2% der Blasentumoren aus.Die Diagnostik und Therapie entspricht operativ der des Blasenkarzinoms. Eine Sonderform ist das Urachuskarzinom, bei dem neben der Blase auch die Verbindung zum Nabel (Urachus) mit entfernt wird.
Plattenepithelkarzinom In westlichen Ländern ist das Plattenepithelkarzinom selten. In Ländern wie ägypten, wo die Bilharziose endemisch ist, kommt das Plattenepithelkarzinom häufiger vor. Die operative Therapie entspricht der des Blasenkarzinoms.
Chemotherapieschemata beim fortgeschrittenen Harnblasenkarzinom:
CM – 21 Tage Zyklus
Paclitaxel, Carboplatin – 21 Tage Zyklus
Gemcitabine, Cisplatin – 28 Tage Zyklus
|



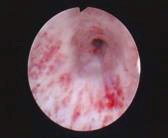


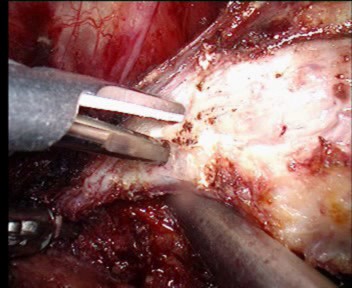
 Kontinente Harnableitung:
Kontinente Harnableitung: