
DNA-Reparatur-Labor
Einleitung
Untersuchungen zur Entstehung von DNA-Schäden und der molekularen Mechanismen für deren Reparatur im Genom von Säugerzellen stehen im Vordergrund der Arbeiten. Insbesondere wird an Nagermodellen und an klinischen Proben die Bedeutung dieser Prozesse für das individuelle Krebsrisiko und für die Entstehung von Therapie-Resistenz bei Tumorerkrankungen untersucht.
Außerdem interessieren wir uns für die komplexe Antwort von Zellen nach DNA-Schädigung durch Zytostatika und die Wechselwirkung mit anderen Funktionen wie Zellzyklus-Regulation und Apoptose.

Jürgen Thomale
Forschungsprojekte aus dem DNA Reparatur Labor
Regulierung der DNA-Reparaturfunktionen in Säugetierzellen
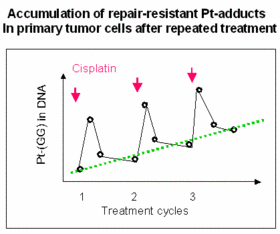
Die Fähigkeit von Säugetierzellen, mit DNA-Läsionen umzugehen, variiert je nach Zelltyp und Differenzierung. Beim Menschen wurden auch deutliche interindividuelle Unterschiede beobachtet. Bei der Analyse normaler und bösartiger hämatopoetischer Zellen suchen wir nach gemeinsamen regulatorischen Mustern innerhalb des „DNA-Schadensreaktionsnetzwerks“ und versuchen, ratenlimitierende Schritte entlang der wichtigsten Reparaturwege zu identifizieren. Funktionelle Daten aus leukämischen Zellen deuten darauf hin, dass die strenge Kontrolle und Feinabstimmung dieses komplexen Netzwerks in physiologischen Zellen während der Karzinogenese (teilweise) aufgehoben ist. Eine gelockerte Regulierung der Schadensreaktionsgene wiederum könnte das Herauswachsen resistenter Zellklone in vivo unter dem Selektionsdruck DNA-reaktiver Krebsmedikamente erleichtern.
Mit Hilfe laborgestützter immunanalytischer Techniken können wir arzneimittelinduzierte DNA-Schäden in Einzelzellauflösung sichtbar machen und messen und so solche Prozesse in Modellsystemen und in klinischen Proben analysieren. Unsere Forschung konzentriert sich vor allem auf die Rolle von DNA-Reparaturmechanismen für das individuelle Krebsrisiko und für die Chemosensitivität von z.B. hämatopoetischen Stamm- und Vorläuferzellen.
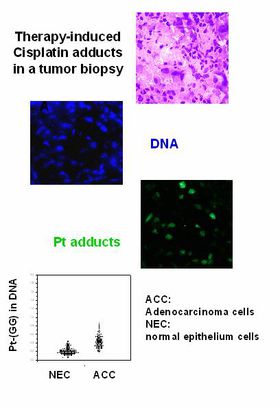
Globale genomische vs. genspezifische Reparatur: Was ist wichtig für die Wirksamkeit von Krebsmedikamenten, die mit der DNA interagieren?
Je nach ihrer tatsächlichen Position im Genom von Säugetierzellen können strukturelle Läsionen unterschiedlich lange bestehen bleiben. Diese „Toposelektivität“ der DNA-Reparatur ist auf spezialisierte Mechanismen zurückzuführen, die sich nur um aktive Gene oder deren transkribierten Strang kümmern (transkriptionsgekoppelte Reparatur; TCR). Diese spezifischen Merkmale haben einen großen Einfluss auf die mutagene und zytotoxische Potenz von DNA-schädigenden Substanzen. Die relative Bedeutung der „toposelektiven“ gegenüber der globalen genomischen Reparatur für die Chemosensitivität von Tumorzellen ist jedoch weitgehend unbekannt.
Experimente, bei denen Wildtyp- und TCR-defiziente Mäuse verglichen wurden, haben ein verändertes Toxizitätsprofil für eine Reihe von Krebsmedikamenten bei „k.o.-Tieren“ gezeigt. Somit können Schlüsselkomponenten dieser Signalwege als potenzielle Zielmoleküle für die pharmakologische Modulation der Arzneimittelresistenz identifiziert werden. Unsere Gruppe hat monoklonale Antikörper für arzneimittelinduzierte DNA-Läsionen entwickelt, um deren sequenzspezifische Verteilung und Eliminierung im normalen und im Tumorgewebe zu überwachen.
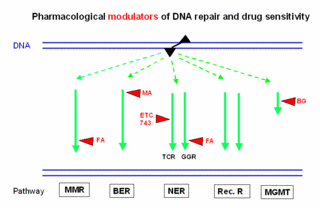
Interferenz von signalmodulierenden Medikamenten mit der zellulären Verarbeitung von DNA-Schäden
Krebsbehandlungspläne enthalten häufig Moleküle, die kritische regulatorische Funktionen in Tumorzellen modulieren. Einige dieser „Signalmodulatoren“ zeigen eine ausgeprägte Wirkungsverstärkung, wenn sie mit DNA-reaktiven Zytostatika kombiniert werden. Die Schnittstelle für diesen Synergismus liegt wahrscheinlich in dem komplexen Netzwerk, das die zelluläre Antwort auf eine DNA-Verletzung koordiniert. In Zusammenarbeit mit der Gruppe von Dr. Moritz (Experimentelle Hämatologie, Tumorklinik) untersuchen wir das Zusammenspiel von Signalmodulation und DNA-Reparaturfunktionen in Zelllinien und in primären Tumorzellen, um Informationen für rationale Medikamentenkombinationen zu gewinnen.
Zelluläre und molekulare Parameter, die die gewebespezifische Toxizität von Arzneimitteln bestimmen
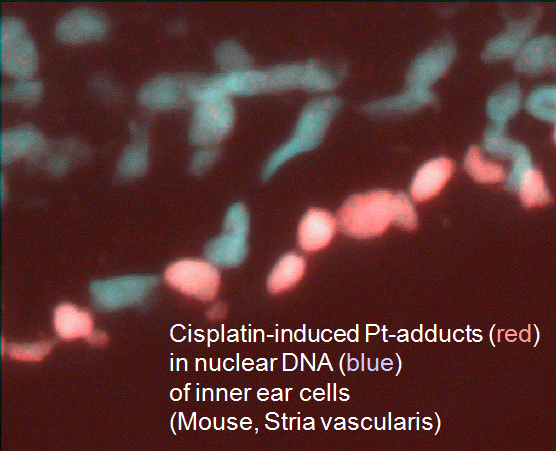
Krebsmedikamente rufen häufig ein typisches Spektrum toxischer Nebenwirkungen hervor, wodurch die anwendbaren Dosen begrenzt werden. Diese Toxizität kann mit einer verstärkten Bildung oder einer längeren Persistenz von medikamenteninduzierten DNA-Läsionen in kritischen Zellen des betroffenen Gewebes zusammenhängen. Als Paradigma analysieren wir die molekularen und zellulären Mechanismen, die der schweren Zytotoxizität z.B. im Innenohr und im peripheren Nervensystem nach Cisplatin-Chemotherapie zugrunde liegen (Zusammenarbeit mit Kollegen der Neurologie und HNO-Klinik). Anhand von normalen und reparaturtransgenen Mausmodellen haben wir gezeigt, dass das Risiko einer Cisplatin-induzierten Polyneuropathie mit der Aktivität eines spezifischen DNA-Reparaturweges in den Spinalganglienzellen zusammenhängt.
Andererseits fällt das Auftreten von Taubheit nach einer Cisplatin-Behandlung mit einer sehr hohen Anhäufung von arzneimittelinduzierten Addukten in einer kleinen Anzahl spezifischer Zellen in der Cochlea zusammen. Wir versuchen, relevante pharmakodynamische Parameter (wie Membrantransporter) und die Kaskade aufeinander folgender Ereignisse zu identifizieren, die zum Funktionsverlust führen. Außerdem können die etablierten Mausmodelle zur Entwicklung und Validierung neuer Schutzstrategien eingesetzt werden.
