
AG Entwicklungsbiologie
Einleitung
Untersuchungen zur Bedeutung und Funktion zellspezifischer Transkriptionsfaktoren bei der Differenzierung von Zellen und in der Embryogenese standen im Mittelpunkt der Forschungsarbeiten. Hierbei interessierten vor allem Transkriptionsfaktoren, deren Fehlfunktion zu Krankheiten wie Krebs, Diabetes und Nierenversagen beim Menschen führen. Als experimentelle Systeme wurden Zellkulturen zum Studium der Zelldifferenzierung sowie Embryonen des Krallenfrosches Xenopus als Modell für die Entwicklung eingesetzt.
Transgene Xenopus-Stämme
DNA-KONSTRUKTE
Die wichtigsten im Labor hergestellten DNA-Konstrukte sind bei addgene erhältlich:
https://www.addgene.org/Gerhart_Ryffel/
ZELLLINIEN
INS-1 und HEK293 Zelllinien für die konditionale Expression von Transgenen, wie sie publiziert wurden (Thomas et al. 2004, Lucas et al. 2005, Senkel et al. 2005, Erdmann et al. 2007, Senkel et al. 2009, Waldner et al. 2011, eingereicht), sind bei Sabine Senkel erhältlich:
sabine.senkel@uni-due.de.
TRANSGENE STÄMME VON XENOPUS LAEVIS
Hinterlegt im European Xenopus Resource Centre der Universität Portsmouth http://www.port.ac.uk/research/exrc und am Marine Biological Laboratory (MBL), Woods Hole http:/www.mbl.edu/xenopus/laevis-stocks
(a) REPORTER STÄMME
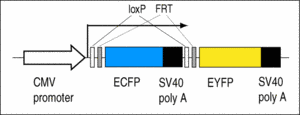
C5: Enthält den Cre/FLP-Reporter LCMV:ECFP(loxP)(FRT)EYFP.
Die Larven zeigen eine blaue Fluoreszenz, die sich bei Einwirkung der Cre- oder FLP-Rekombinase in eine gelbe Fluoreszenz verwandelt (Ryffel et al., 2003; Waldner et al., 2006).
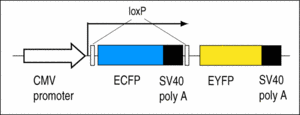
Y2: Enthält den Cre-Reporter CMV:ECFP(loxP)EYFP.
Die Larven zeigen eine blaue Fluoreszenz, die bei Einwirkung der Cre-Rekombinase in eine gelbe Fluoreszenz übergeht (Ryffel et al., 2003).
GpL8:
Enthält den Cre-Reporter CMV:ECFP(loxP)LacZ.
Die Larven zeigen eine grüne Fluoreszenz, die sich bei Einwirkung der Cre-Rekombinase in eine ß-Galaktosidase-Aktivität verwandelt, die durch LacZ-Färbung sichtbar gemacht werden kann (Waldner et al., 2006).
Tom3:
Dieser Stamm enthält ein CMV-getriebenes rot fluoreszierendes Protein (tdTomato, freundlicherweise zur Verfügung gestellt von Shaner et al., 2004). Erwachsene Tiere dieses Stammes zeigen eine ubiquitäre und homogene Expression des rot fluoreszierenden Proteins (Abb. 1), was darauf hindeutet, dass der CMV-Promotor auch in späteren Entwicklungsstadien zur Expression von Transgenen verwendet werden kann (Waldner et al., 2006).
Die Abbildung zeigt einen erwachsenen Frosch des CMV:tdTomato-Stammes tom3.
A: Kopf beleuchtet für rote Fluoreszenz.
B und C: Präpariertes Mesonephros eines tom3-Tieres (rechts) oder eines Kontrolltieres (links) bei normalem Licht (B) oder roter Fluoreszenz (C).
(b) EFFEKTOR STÄMME
328del-4:
Enthält den Cre/FLP-Effektor CMV:ECFP(loxP)(FRT)HNF1BP328L329del.
Die Larven zeigen blaue Fluoreszenz und exprimieren nach Cre-Rekombinase-Aktion die menschliche HNF1B-Mutation P328L329 (Roose et al., 2009).
328del-3:
Enthält den Cre/FLP-Effektor CMV:ECFP(loxP)(FRT)HNF1BP328L329del und ist eine von 328del-4 unabhängige Linie mit sehr ähnlichen Eigenschaften. Die Larven zeigen blaue Fluoreszenz und exprimieren nach Cre-Rekombinase-Aktion die menschliche HNF1B-Mutation P328L329 (Roose et al., 2009).
A263ins-6:
Enthält den Cre/FLP-Effektor CMV:ECFP(loxP)(FRT)HNF1BA263insGG. Die Larven zeigen blaue Fluoreszenz und exprimieren nach Cre-Rekombinase-Aktion die menschliche HNF1B-Mutation A263insGG (Sauert et al., 2011).
(c) REKOMBINASE STÄMME
A7:
Enthält das CAR-Cre-Konstrukt, das für die kodierende Sequenz der Cre-Rekombinase unter Kontrolle des kardialen Aktinpromotors kodiert. Die Cre-Aktivität wurde durch Kreuzung mit den Reporterstämmen C5, Y2 und GpL8 nachgewiesen (Waldner et al., 2006).
HSPCre1:
Dieser Stamm enthält eine Cre-Rekombinase unter dem Hitzeschockpromotor HSP70. F1-Tiere dieses Stammes, die mit dem C5-Reporterstamm gekreuzt wurden, zeigen eine ubiquitäre Induktion des EYFP-Reporters bei Hitzeschock. Die DNA-Rekombination wurde bereits eine Stunde nach Beginn der Hitzeschockbehandlung beobachtet (Roose et al., 2009).
HSPCre1;C5:
Diese Frösche stammen aus einer Kreuzung zwischen HSPCre1 und C5. Sie wurden in der Embryogenese hitzeschockbehandelt und die gelben Larven (aktiviertes EYFP) wurden aufgezogen.
HSPCre13:
Dieser Stamm enthält eine Cre-Rekombinase unter dem Hitzeschockpromotor HSP70. Da dieser Stamm ein gekoppeltes CMV-getriebenes Gen enthält, das für das rot fluoreszierende Protein tdTomato kodiert, können Nachkommen mit Cre-Rekombinase leicht identifiziert werden. F1-Tiere dieses Stammes, die mit dem C5-Reporterstamm gekreuzt wurden, zeigen eine ubiquitäre Induktion des EYFP-Reporters bei Hitzeschocks (Roose et al., 2009; Sauert et al., 2011).
Referenzliste
Roose,M., Sauert,K., Turan,G., Solomentsew,N., Werdien,D., Pramanik,K., Senkel,S., Ryffel,G.U., and Waldner,C. (2009). Heat-shock inducible Cre strains to study organogenesis in transgenic Xenopus laevis. Transgenic Res. 18, 595-605.
Ryffel,G.U., Werdien,D., Turan,G., Gerhards,A., Goosses,S., and Senkel,S. (2003). Tagging muscle cell lineages in development and tail regeneration using Cre recombinase in transgenic Xenopus. Nucleic Acids Res. 31, e44.
Sauert,K., Kahnert,S., Roose,M., Gull,M., Brändli,A.W., Ryffel,G.U., and Waldner,C. (2011). Heat-shock mediated overexpression of HNF1b mutations has differential effects on gene expression in the Xenopus pronephric kidney. PLoS. ONE. submitted.
Waldner,C., Roose,M., and Ryffel,G.U. (2009). Red fluorescent Xenopus laevis: a new tool for grafting analysis. BMC. Dev. Biol. 9, 37.
Waldner,C., Sakamaki,K., Ueno,N., Turan,G., and Ryffel,G.U. (2006). Transgenic Xenopus laevis strain expressing cre recombinase in muscle cells. Dev. Dyn. 235, 2220-2228.

Univ.-Prof. Dr.
Gerhart U. Ryffel
Im Ruhestand
